| Facultad
de Ciencias Exactas y Naturales-UBA AÑO 14 - NÚMERO 498 JUEVES, 6 DE MAYO DE 2004 |
|
| Principal | Archivo |
La
célula pudo ser visualizada molécula a molécula
Desarrollan herramientas para ver los procesos celulares "en directo"
Un equipo de la Facultad de Ciencias Exactas y Naturales de la UBA junto con investigadores del Instituto Max Planck de Alemania aplicaron una técnica que permite ver en detalle y en vivo los procesos que ocurren en el interior de la célula. Se publicó en la prestigiosa revista Nature Biotechnology, y podrá tener aplicaciones en el diagnóstico temprano de tumores.
Por Susana Gallardo (*)
 Se
sabe que en el interior de cada célula viva hay una actividad febril:
infinidad de moléculas entran y salen, se comunican entre sí, se unen
o se separan, todo a velocidades imposibles de describir. Hasta hace algunos
años, estos eventos podían conocerse sólo de manera indirecta. Pero la
obstinación humana ha llevado a diseñar herramientas para ver el proceso
en vivo y en directo. Y ello permitirá instrumentar técnicas de diagnóstico
más precisas, por ejemplo, para detectar un cáncer en una etapa muy temprana.
Se
sabe que en el interior de cada célula viva hay una actividad febril:
infinidad de moléculas entran y salen, se comunican entre sí, se unen
o se separan, todo a velocidades imposibles de describir. Hasta hace algunos
años, estos eventos podían conocerse sólo de manera indirecta. Pero la
obstinación humana ha llevado a diseñar herramientas para ver el proceso
en vivo y en directo. Y ello permitirá instrumentar técnicas de diagnóstico
más precisas, por ejemplo, para detectar un cáncer en una etapa muy temprana.
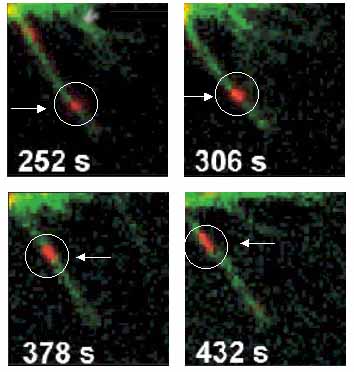
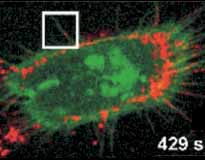
Una técnica de fluorescencia hizo posible ver en detalle, en una célula viva, cómo una molécula biológica, un factor de crecimiento epidérmico, se une, en la membrana celular, con una molécula receptora y se introduce en el interior de la célula. Este resultado fue publicado en Nature Biotechnology por la doctora Elizabeth Jares, profesora en la Facultad de Ciencias Exactas y Naturales de la UBA e investigadora del Conicet, y el licenciado Hernán Grecco, del laboratorio de Electrónica Cuántica de la misma Facultad, junto con investigadores del grupo del doctor Thomas Jovin, del Instituto Max Planck, en Gotinga, Alemania.
Lo que hizo Jares, en su laboratorio del Departamento de Química Orgánica de la FCEyN, fue modificar la superficie y caracterizar las propiedades de pequeñas esferas de un material semiconductor que emite una fluorescencia cuando es irradiado con luz. Se trata de una fluorescencia muy brillante, tanto que permite seguir el recorrido de una sola molécula en el interior de una célula.
"La microscopía de fluorescencia se viene empleando desde hace años para estudiar una gran variedad de procesos celulares. Pero, hasta ahora, sólo se podían ver grupos de cientos o miles de moléculas. En cambio, el empleo de estas nanopartículas (de un tamaño 200 mil veces más pequeño que el milímetro) permite ver una sola molécula y seguir su destino usando microscopios convencionales", explica la investigadora.
Indagar el derrotero de una sola molécula
Es como si, desde un avión, quisiéramos seguir el recorrido de un individuo por la calle Florida. Desde arriba sólo veremos una masa indistinguible de gente. Pero, si a nuestro candidato le ponemos un sombrero de un rojo especialmente brillante, podremos distinguir ese punto rojo y seguir su derrotero, por ejemplo, ver en qué negocios entra y cuánto tiempo permanece en cada uno. Incluso podremos determinar en qué momento se encuentra con su novia, que tendrá un sombrero verde. Luego, será posible espiar el recorrido de ambos.
"Distinguir el accionar de cada molécula biológica nos provee de una información detallada imposible de lograr cuando observamos el comportamiento conjunto de un grupo de ellas", asegura Jares. Pero, para distinguir una sola molécula, la marca debe ser muy brillante. Y, precisamente, las nanopartículas en cuestión poseen esa propiedad.
¿Cómo trabajan las nanopartículas? Los investigadores liberan estas pequeñas esferas en un cultivo celular y ellas, al tener en su superficie una molécula específica, se unen con ciertas proteínas que constituyen el blanco que se quiere rastrear. Al ser iluminadas con el láser, la esfera (fabricada con un material semiconductor) emite una luminosidad de un rojo brillante. La molécula con la que se debe unir fue modificada genéticamente para que emita una fluorescencia verde. Cuando ambas se encuentran, la imagen que provee una cámara digital muestra un punto de color anaranjado brillante, cuyo recorrido es seguido de cerca.
En imágenes puede verse cómo el factor de crecimiento epidérmico se une con los receptores específicos de la membrana celular. Luego, esos receptores pueden, a su vez, unirse entre sí y a otros receptores formando complejos. Lo importante es que algunos de estos complejos fueron hallados en gran cantidad en células tumorales. Se los encontró en cáncer de cabeza, cuello, mama, vejiga, próstata, riñón, colon, esófago, endometrio y cuello de útero. De hecho, son el blanco obligado de drogas contra el cáncer.
El experimento realizado permitió determinar que un receptor en particular es el que está más involucrado con el control de los procesos tumorales. Y este dato es de interés para la industria farmacológica.
En uno de los varios comentarios elogiosos que recibió el trabajo, los doctores Gal Gur y Yosef Yarden, del Instituto Weizman, de Rehovot, Israel, señalan en Nature Biotechnology: "Estas nanopartículas permiten hacer un rastreo detallado en células vivas con una resolución nunca antes lograda. Otras técnicas de imágenes sólo brindaban instantáneas breves con muy baja resolución espacial".
Para los investigadores, estas pequeñas partículas encontrarán un número de aplicaciones cada vez mayor en la ciencia básica y aplicada. "El poder de las imágenes de darnos información en forma directa constituye un aspecto realmente fascinante de estos nuevos marcadores", concluye Jares, cuyo laboratorio ha sido propuesto como grupo asociado externo de la Sociedad Max Planck, que reúne a todos los institutos que esa organización posee en Alemania. Esto significa recibir una cantidad de dinero, durante cinco años, para el funcionamiento del grupo.
|
|
(*) Centro de Divulgación Científica, FCEyN.
| Portada | Archivo |